Главное
«Саксенда» (Saxenda, лираглутид) одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) для применения подростками (12 лет и старше) в качестве дополнения к низкокалорийной диете и усиленной физической нагрузке в целях коррекции массы тела. Препарат разрешен в том случае, если вес превышает 60 кг, а скорректированный на возраст и пол подростков индекс массы тела (ИМТ) ≥ 30 кг/м2, что соответствует ожирению у взрослых.
Ранее «Саксенда», предложенный «Ново Нордиск» (Novo Nordisk) в 2014 году, был дозволен для использования только взрослыми.
Подключение к «Саксенде» пациентов подросткового возраста — важное событие. Во-первых, за минувшие 20 лет распространенность избыточного веса среди детей и подростков удвоилась: с 10% до 20%. Доказано, что если оба родителя имеют проблемный вес, то в 80% случаев это же будет справедливо и для ребенка. В целом лишний вес является глобальной проблемой: в 2021 году насчитали более чем 1,9 млрд взрослых (в том числе свыше 650 тыс. тучных), которым так или иначе не помешало бы похудеть.
Во-вторых, орлистат (orlistat) и фентермин (phentermine) — единственные лекарственные препараты, дозволенные FDA для применения в педиатрической популяции (соответственно в возрасте от 12 и 16 лет). В Европе нет разрешенных лекарственных средств против ожирения у детей и подростков. Кроме того, бариатрическая хирургия, как наиболее эффективная для устранения лишних килограммов, предлагается подросткам только в том случае, если они страдают тяжелой формой ожирения.
«Саксенда» (Saxenda, лираглутид).
Дозировка и передозировка
Начальная доза для взрослого содержит обычно максимум 0,6 мг в сутки, максимально стоит назначать – 3 мг в сутки. В одном шприце – 3 мл, в котором содержится 6 мг основного вещества.
Важно! На сколько хватает упаковки, то есть 9 мл препарата. Одна доза – 0,6 мг – это 0,3 мл, одного шприца хватает на 10 доз, а трех – на 30, на 1 месяц применения.
Терапевтический эффект максимум должен наступить после 12-и недель курса, если масса тела не уменьшилась за это время больше чем на 5% при максимально допустимой дозе в 3 мг в сутки, терапию стоит отменить.
Людям пожилого возраста, больше 65-и лет не требуется коррекция дозы, как и людям с хроническими заболеваниями мочевыделительной и желчевыделительной систем с легкой или средней почечной или печеночной недостаточностью. При тяжелых формах стоит проконсультироваться со специалистами, гепатологом и нефрологом для решения о назначении препарата.
Каждая такая специальная ручка-шприц очень проста в использовании. В ней есть шкалы, показывающие, сколько нужно вводить и сколько остается медикамента. В каждой упаковке находится подробное руководство, как правильно пользоваться ручкой, как правильно ее хранить уже в открытом виде.
Случаи передозировки были описаны, максимальная доза составляла – 72 мг. При такой концентрации препарат может оказывать вред организму. Симптомы передозировки:
- Гипогликемия, но без установления гипогликемического шока;
- Сильная тошнота и частая рвота с болью в животе.
Все случаи лечатся симптоматически, инфузионной терапией.
Что такое дислипидемия
Подробности
Клиническое исследование NCT02918279 фазы III (рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое, международное) изучило безопасность и эффективность коррекции веса среди пациентов (n=251) подросткового возраста (12–17 лет), страдающих ожирением.
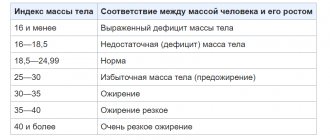
Диагноз ожирения ставился при ИМТ, который соответствовал значению 30 кг/м2 и более для взрослых и который ввиду неоднородности был скорректирован сообразно международным критериям оценки ИМТ у подростков, причем на уровне не менее чем 95-го процентиля справочного показателя, отвечающего возрасту и полу.
Участникам назначали плацебо или лираглутид в дозе максимум 3,0 мг (доза повышалась постепенно до предельно переносимой) — ежедневными подкожными инъекциями на протяжении 56 недель. Испытуемые должны были придерживаться курса изменения образа жизни.
Первичная конечная точка была установлена изменением ИМТ по коэффициенту стандартного отклонения (SDS). Под последним, также известным как Z-оценка, понимали число стандартных отклонений от усредненного в популяции ИМТ, приведенного к возрасту и полу.
Группа лираглутида превзошла контрольную группу по всем показателям:
Усредненное абсолютное изменение ИМТ составило −1,6 ±3,1 кг/м2 — против +0,1 ±3,4 кг/м2. Усредненное абсолютное изменение массы тела вышло к −2,7 ±9,1 кг — против +1,7 ±10,1 кг.
После отмены лираглутида показатели веса начали вновь расти, причем в группе «Саксенды» в большей степени, нежели в группе контроля: оценочная разность между группами, согласно ИМТ по SDS, составила 0,15 (95% ДИ: 0,07–0,23). Впрочем, по прошествии 82 недель терапевтический эффект всё же сохранялся: усредненное абсолютное изменение ИМТ составило −0,2 ±3,5 кг/м2 — против +0,8 ±4,0 кг/м2, усредненное абсолютное изменение массы тела получилось равным +1,7 ±10,1 кг — против +4,4 ±11,7 кг.
Среди наиболее распространенных побочных реакций на применение «Саксенды», частота которых была выше, чем в группе плацебо: тошнота (у 42% пациентов), рвота (34%), диарея (22%), гастроэнтерит (13%), головокружение (10%). С течением времени неблагоприятные явления наблюдались существенно реже.
САКСЕНДА р-р д/инъекц. 6 мг/мл картридж 3 мл №5 + шпр.- ручка
Фармакодинамика
Механизм действия
Действующее вещество препарата Саксенда — лираглутид — представляет собой аналог человеческого глюкагоноподобного пептида-1 (ГПП-1), произведнный методом биотехнологии рекомбинантной ДНК с использованием штамма Saccharomyces cerevisiae, имеющий 97% гомологичности аминокислотной последовательности эндогенному человеческому ГПП-1. Лираглутид связывается и активирует рецептор ГПП-1 (ГПП-1Р). Лираглутид устойчив к метаболическому распаду, период его полувыведения из плазмы после подкожного введения составляет 13 ч. Фармакокинетический профиль лираглутида, позволяющий вводить его пациентам 1 раз в сутки, является результатом самоассоциации, в результате которой происходит замедленное всасывание препарата, связывания с белками плазмы, а также устойчивости к дипептидилпептидазе-4 (ДПП-4) и нейтральной эндопептидазе (НЭП).
ГПП-1 является физиологическим регулятором аппетита и потребления пищи. ГПП-1Р обнаружены в нескольких областях головного мозга, задействованных в регулировании аппетита. В исследованиях на животных введение лираглутида приводило к его захвату в специфических областях головного мозга, включая гипоталамус, где лираглутид посредством специфической активации ГПП-1Р усиливал сигналы о насыщении и ослаблял сигналы о голоде, тем самым приводя к уменьшению массы тела.
Лираглутид уменьшает массу тела у человека преимущественно посредством уменьшения массы жировой ткани. Уменьшение массы тела происходит за счт уменьшения потребления пищи. Лираглутид не увеличивает 24-часовой расход энергии. Лираглутид регулирует аппетит с помощью усиления чувства наполнения желудка и насыщения, одновременно ослабляя чувство голода и уменьшая предполагаемое потребление пищи.
Лираглутид стимулирует секрецию инсулина и уменьшает неоправданно высокую секрецию глюкагона глюкозозависимым образом, а также улучшает функцию бета-клеток поджелудочной железы, что приводит к снижению концентрации глюкозы натощак и после прима пищи. Механизм снижения концентрации глюкозы также включает небольшую задержку опорожнения желудка.
Фармакодинамика
В долгосрочных клинических исследованиях с участием пациентов с избыточной массой тела или ожирением применение препарата Саксенда в сочетании с низкокалорийной диетой и усиленной физической активностью приводило к значительному снижению массы тела.
Влияние на аппетит, потребление калорий, расход энергии, опорожнение желудка и концентрацию глюкозы натощак и после прима пищи
Фармакодинамические эффекты лираглутида изучались в пятинедельном исследовании с участием 49 пациентов с ожирением (индекс массы тела (ИМТ) 30-40 кг/м2) без сахарного диабета.
Аппетит, потребление калорий и расход энергии
Считается, что снижение массы тела при применении препарата Саксенда связано с регулированием аппетита и количества потребляемых калорий. Аппетит оценивали перед и в течение 5 ч после стандартного завтрака, неограниченное потребление пищи оценивали во время последующего обеда. Препарат Саксенда увеличивал чувство насыщения и наполнения желудка после прима пищи и уменьшал чувство голода и оценочное количество предполагаемого потребления пищи, а также уменьшал неограниченное потребление пищи по сравнению с плацебо. При оценке с помощью респираторной камеры не было отмечено связанного с терапией увеличения 24-часового расхода энергии.
Опорожнение желудка
Применение препарата Саксенда приводило к небольшой задержке опорожнения желудка в течение первого часа после прима пищи, в результате чего уменьшалась скорость повышения концентрации, а также общая концентрация глюкозы крови после прима пищи.
Концентрация глюкозы, инсулина и глюкагона натощак и после прима пищи
Концентрацию глюкозы, инсулина и глюкагона натощак и после прима пищи оценивали перед и в течение 5 ч после стандартизированного прима пищи. По сравнению с плацебо препарат Саксенда уменьшал концентрацию глюкозы крови натощак и после прима пищи (AUC0-60 мин) в течение первого часа после прима пищи, а также уменьшал 5-часовую AUC глюкозы и нарастающую концентрацию глюкозы (AUC0-300 мин)- Кроме того, препарат Саксенда уменьшал постпрандиальную концентрацию глюкагона (AUC0-300 мин) и инсулина (AUC0-60 мин) и нарастающую концентрацию инсулина (iAUC0-60 мин) после прима пищи по сравнению с плацебо.
Концентрацию натощак и нарастающую концентрацию глюкозы и инсулина также оценивали во время перорального теста толерантности к глюкозе (ПТТГ) с 75 г глюкозы перед и через 1 год терапии у 3731 пациента с ожирением и с нарушением толерантности к глюкозе и без нарушения толерантности к глюкозе. По сравнению с плацебо препарат Саксенда уменьшал концентрацию натощак и нарастающую концентрацию глюкозы. Эффект был более выраженным у пациентов с нарушением толерантности к глюкозе. Кроме того, препарат Саксенда уменьшал концентрацию натощак и увеличивал нарастающую концентрацию инсулина по сравнению с плацебо.
Влияние па концентрацию натощак и нарастающую концентрацию глюкозы у пациентов с сахарным диабетом 2 типа с избыточной массой тела или ожирением
Препарат Саксенда снижал концентрацию глюкозы натощак и среднюю нарастающую постпрандиальную концентрацию глюкозы (через 90 минут после прима пищи, среднее значение для 3-х примов пищи в сутки) по сравнению с плацебо.
Функция бета-клеток поджелудочной кислоты
В клинических исследованиях продолжительностью до одного года с применением препарата Саксенда у пациентов с избыточной массой тела или ожирением и с сахарным диабетом или без такового было продемонстрировано улучшение и сохранение функции бета-клеток поджелудочной железы при использовании таких методов измерения, как гомеостатическая модель оценки функции бета-клеток (НОМА-В) и соотношение концентраций проинсулина и инсулина.
Клиническая эффективность и безопасность
Эффективность и безопасность применения препарата Саксенда для длительной коррекции массы тела в сочетании с низкокалорийной диетой и усилением физической активности была изучена в 4-х рандомизированных двойных слепых плацебо-контролируемых исследованиях (3 исследования продолжительностью 56 недель и 1 исследование продолжительностью 32 недели). Исследования включали в общей сложности 5358 пациентов 4 различных популяций: 1) пациенты с ожирением или избыточной массой тела, а также с одним из следующих состояний/заболеваний: нарушение толерантности к глюкозе, артериальная гипертензия, дислипидемия, 2) пациенты с ожирением или избыточной массой тела с недостаточно контролируемым сахарным диабетом 2 типа (значение НbА1с в диапазоне 7- 10%), до начала исследования для коррекции НbА1с у этих пациентов применяли: диету и физические упражнения, метформин, препараты сульфонилмочевины, глитазона по отдельности или в любых комбинациях, 3) пациенты с ожирением с обструктивным апноэ средней или тяжлой степени, 4) пациенты с ожирением или избыточной массой тела и сопутствующей артериальной гипертензией или дислипидемией, которые достигли снижения массы тела не менее чем на 5% с помощью низкокалорийной диеты.
Масса тела
Более выраженное снижение массы тела было достигнуто у пациентов с ожирением/ избыточной массой тела, получавших препарат Саксенда, по сравнению с пациентами, получавшими плацебо, во всех исследованных группах, в том числе с наличием или отсутствием нарушения толерантности к глюкозе, сахарным диабетом 2 типа и обструктивным апноэ средней или тяжлой степени. В исследовании №1 (пациенты с ожирением и избыточной массой тела с наличием или отсутствием нарушения толерантности к глюкозе) снижение массы тела составило 8,0% у пациентов, получавших препарат Саксенда, по сравнению с 2,6% в группе плацебо. В исследовании № 2 (пациенты с ожирением и избыточной массой тела с сахарным диабетом 2 типа) снижение массы тела составило 5,9% у пациентов, получавших препарат Саксенда, по сравнению с 2,0% в группе плацебо. В исследовании №3 (пациенты с ожирением и избыточной массой тела с обструктивным апноэ средней или тяжлой степени) снижение массы тела составило 5,7% у пациентов, получавших препарат Саксенда, по сравнению с 1,6% в группе плацебо. В исследовании №4 (пациенты с ожирением и избыточной массой тела после предшествующей потери массы тела не менее чем 5%) дальнейшее снижение массы тела составило 6,3% у пациентов, получавших препарат Саксенда, по сравнению с 0,2% в группе плацебо. В исследовании №4 большее количество пациентов сохранили потерю массы тела, которая была достигнута до начала лечения препаратом Саксенда по сравнению с плацебо (81,4% и 48,9%, соответственно). Кроме того, во всех исследованных популяциях, большая часть пациентов, получавших препарат Саксенда, достигли снижения массы тела не менее чем на 5% и более чем на 10% по сравнению с пациентами, получавшими плацебо.
В исследовании №1 (пациенты с ожирением и избыточной массой тела с наличием или отсутствием нарушения толерантности к глюкозе) снижение массы тела не менее чем 5% на 56 неделе терапии отмечено у 63,5% пациентов, получавших препарат Саксенда, по сравнению с 26,6% в группе плацебо. Соотношение пациентов, у которых снижение массы тела на 56 неделе терапии достигло более чем 10%, составляет 32,8% в группе пациентов, получавших препарат Саксенда, по сравнению с 10,1% в группе плацебо. В целом снижение массы тела произошло у приблизительно 92% пациентов, получавших препарат Саксенда, по сравнению с приблизительно 65% в группе плацебо.
Снижение массы тела после 12 недель терапии препаратом Саксенда
Пациенты с ранним ответом на терапию были определены как пациенты, у которых было достигнуто снижение массы тела не менее чем на 5% после 12 недель терапии (4 недели увеличения дозы и 12 недель терапии в дозе 3 мг).
В двух исследованиях (пациенты с ожирением или избыточной массой тела без и с сахарным диабетом 2 типа) у 67,5% и 50,4% пациентов было достигнуто снижение массы тела не менее чем на 5% после 12 недель терапии. При продолжении терапии препаратом Саксенда (до 1 года) 86,2% из этих пациентов достигли снижения массы тела не менее чем на 5% и 51% — не менее чем на 10%. Среднее снижение массы тела у этих пациентов, завершивших исследование, составило 11,2% по сравнению с исходным значением. У пациентов, достигших снижения массы тела менее чем на 5% после 12 недель терапии в дозе 3 мг и завершивших исследование (1 год), среднее снижение массы тела составило 3,8%.
Контроль гликемии
Терапия препаратом Саксенда существенно улучшала гликемические показатели в субпопуляциях с нормогликемией, нарушением толерантности к глюкозе (среднее снижение НbА1с — 0,3%) и сахарным диабетом 2 типа (среднее снижение НbА1с — 1,3%) по сравнению с плацебо (среднее снижение НbА1с — 0,1% и — 0,4%, соответственно). В исследовании с участием пациентов с нарушением толерантности к глюкозе сахарный диабет 2 типа развился у меньшего числа пациентов, получавших препарат Саксенда, по сравнению с группой плацебо (0,2% и 1,1%, соответственно). У большего числа пациентов с нарушением толерантности к глюкозе наблюдалось обратное развитие этого состояния по сравнению с группой плацебо (69,2% и 32,7%, соответственно).
В исследовании с участием пациентов с сахарным диабетом 2 типа 69,2% и 56,5% пациентов, получавших препарат Саксенда, достигли целевого значения НbА1с <, 7% и <, 6,5%, соответственно, по сравнению с 27,2% и 15,0% у пациентов, получавших плацебо.
Кардиометаболические параметры
В исследовании с участием пациентов с ожирением или избыточной массой тела с или без нарушения толерантности к глюкозе при применении препарата Саксенда наблюдалось существенное снижение систолического артериального давления (на 4,3 пункта против 1,5 пункта), диастолического артериального давления (на 2,7 пункта против 1,8 пункта), окружности талии (на 8,2 см против 4,0 см) и значительное изменение концентрации липидов натощак (снижение общего холестерина на 3,2% против 0,9%, снижение липопротеинов низкой плотности на 3,1% против 0,7%, увеличение липопротеинов высокой плотности на 2,3% против 0,5%, снижение триглицеридов на 13,6% против 4,8%) по сравнению с плацебо.
Индекс апноэ-гипноз
При применении препарата Саксенда наблюдалось существенное снижение по сравнению с плацебо тяжести обструктивного апноэ, которая оценивалась по уменьшению индекса апноэ-гипноэ (ИАГ) на 12,2 случаев в час и 6,1 случаев в час, соответственно.
Иммуногенность
С учетом потенциальных иммуногенных свойств белковых и пептидных лекарственных препаратов, у пациентов могут появиться антитела к лираглутиду после терапии препаратом Саксенда. В клинических исследованиях у 2,5% пациентов, получавших препарат Саксенда, появились антитела к лираглутиду. Образование антител не привело к снижению эффективности препарата Саксенда.
Оценка сердечно-сосудистых явлений
Значительные нежелательные сердечно-сосудистые явления (МАСЕ) были оценены группой внешних независимых экспертов и определены как несмертельный инфаркт миокарда, несмертельный инсульт и смерть по причине сердечно-сосудистой патологии. Во всех долгосрочных клинических исследованиях с применением препарата Саксенда было отмечено 6 МАСЕ у пациентов, получавших препарат Саксенда, и 10 МАСЕ — у получавших плацебо пациентов. Отношение рисков и 95% ДИ при сравнении препарата Саксенда и плацебо составило 0,31 0,10, 0,92. В клинических исследованиях 3 фазы наблюдалось увеличение частоты сердечных сокращений (ЧСС) в среднем на 2,5 удара в минуту (от 1,6 до 3,6 удара в минуту в отдельных исследованиях) у пациентов, получавших препарат Саксенда. Наибольшее увеличение ЧСС наблюдалось после 6 недель терапии. Это увеличение было обратимым и исчезало после прекращения терапии лираглутидом.
Результаты по оценке пациентов
Препарат Саксенда по сравнению с плацебо улучшал определяемые пациентами оценки по отдельным показателям. Было отмечено значительное улучшение общей оценки по Упрощнному опроснику влияния массы тела на качество жизни (IWQoL-Lite) и по всем шкалам опросника для оценки качества жизни SF-36, что указывает на положительное влияние на физический и психологический компоненты качества жизни.
Доклинические данные
по безопасности
Доклинические данные, основанные на исследованиях фармакологической безопасности, токсичности повторных доз и генотоксичности, не выявили какой-либо опасности для человека.
В двухлетних исследованиях канцерогенности у крыс и мышей были выявлены опухоли С-клеток щитовидной железы, не приводившие к летальному исходу. Нетоксическая доза (NOAEL) у крыс не установлена. У обезьян, получавших терапию в течение 20 месяцев, развития этих опухолей не наблюдалось. Результаты, полученные в ходе исследований на грызунах, обусловлены тем, что грызуны проявляют особую чувствительность в отношении опосредуемого рецептором ГПП-1 не генотоксичного специфического механизма. Значимость полученных данных для человека является низкой, однако не может быть полностью исключена. Появления других новообразований, связанных с проводимой терапией, отмечено не было.
В исследованиях на животных не выявлено прямого неблагоприятного эффекта препарата на фертильность, но было отмечено незначительное увеличение частоты ранней эмбриональной смерти при применении самых высоких доз препарата. Введение лираглутида в середине гестационного периода вызвало уменьшение массы тела матери и роста плода с неизученным до конца влиянием на ребра у крыс, а у кроликов — отклонения в строении скелета. Рост новорожднных был снижен у крыс во время терапии лираглутидом, и это снижение сохранялось после окончания грудного вскармливания в группе, получавшей высокие дозы препарата. Неизвестно, чем обусловлено такое снижение роста новорожднных особей крыс — снижением потребления калорий материнскими особями или прямым влиянием ГПП-1 на плод/новорожднных.